— Tutorial nº 156 —
Propiedades del Litio y sus Aplicaciones
Índice de contenidos:
1- Introducción
1.1- Generalidades
1.2- Propiedades químicas del litio
1.3- Presencia del litio en la naturaleza
1.4- Métodos industriales para la obtención de litio
2- Principales aplicaciones del litio
2.1- Generalidades
2.2- Baterías de ion de litio
2.3- Industria del aluminio y de aleaciones ligeras
2.4- Industria del vidrio y la cerámica
2.5- Grasas y lubricantes
2.6- Sistemas de aire acondicionado y control de humedad
2.7- Fabricación de caucho sintético
2.8- Psicofármacos
2.9- Depuradores de aire
2.10- Futuros usos para el litio
3- Consideraciones sobre seguridad y salud en el uso del litio
3.1- Efectos del litio sobre la salud
3.2- Riesgos químicos del litio
3.3- Efectos medioambientales del litio
DESARROLLO DEL CONTENIDO
1- Introducción
El litio, cuyo nombre proviene del vocablo griego lithos, que significa "piedra", es un elemento de la naturaleza, de símbolo químico ‹‹ Li ››, perteneciente al grupo 1 de la tabla periódica de los elementos, y que junto al sodio (Na), potasio (K), rubidio (Rb), cesio (Cs) y francio (Fr) forma parte de los denominados metales alcalinos.
Todos los metales alcalinos tienen en común una configuración electrónica caracterizada por poseer su electrón más externo en un orbital s, hecho que les proporciona a todos los elementos alcalinos propiedades características muy similares. En muchas ocasiones, la familia de los alcalinos es también conocida como la familia del litio, al ser éste su primer elemento.

— Piedras de sales de litio —
El litio es, a su vez, el metal y elemento sólido más ligero de la naturaleza. El litio, en su forma pura, es blando, de muy baja densidad y de un color característico blanco plata. Es un metal de bajo punto de fusión, que hace que el litio se presente en fase líquida dentro de un amplio intervalo de temperatura, además de tener un alto calor específico (capacidad calorífica). Presenta también una alta conductividad térmica, y es un mineral de baja viscosidad. El litio metálico es soluble en aminas alifáticas de cadena corta, como la etilamina, y es insoluble en los hidrocarburos.
El litio es un elemento fuertemente electropositivo dado su gran tendencia a perder su electrón más externo. Este hecho hace que el litio sea un elemento muy reactivo que experimenta un gran número de reacciones, tanto con agentes químicos orgánicos como inorgánicos, lo que implica que el litio no se encuentre puro en la naturaleza, sino que aparezca ligado siempre con otros elementos formando compuestos.
De hecho, el litio se oxida rápidamente cuando entra en contacto con el aire o el agua. Así, el litio reacciona con el oxígeno para formar el monóxido (Li2O) y el peróxido de litio (Li2O2). Es el único metal alcalino que reacciona con el nitrógeno a temperatura ambiente para producir un nitruro de litio, el cual es de color negro.
El litio reacciona fácilmente también con el hidrógeno a casi 500ºC (930ºF) para formar hidruro de litio. La reacción del litio metálico con el agua es extremadamente fuerte, por lo que habrá que extremar la precaución si ocurre este hecho.
El litio reacciona en forma directa con el carbono para producir el correspondiente carburo de litio. El litio también se combina fácilmente con los halógenos, formando compuestos halogenuros con emisión de luz. Aunque no reacciona con hidrocarburos parafínicos, experimenta reacciones de adición con alquenos sustituidos por grupos arilo y dienos. También reacciona con compuestos acetilénicos, formando acetiluros de litio, los cuales son importantes para la síntesis de la vitamina A.
1.2- Propiedades químicas del litio
A continuación, se incluye una tabla resumen con las principales propiedades químicas del litio:
Tabla 1. Propiedades químicas del litio |
|
Nombre |
Litio |
Número atómico |
3 |
Peso atómico |
6,941 |
Valencia |
1 |
Estado de oxidación |
+1 (base fuerte) |
Electronegatividad |
1,0 |
Radio covalente (Å) |
1,34 |
Radio iónico (Å) |
0,60 |
Radio atómico (Å) |
1,55 |
Configuración electrónica |
1s2 2s1 |
Primer potencial de ionización (eV) |
5,41 |
Masa atómica (u.m.a.) |
6,941 |
Masa molar (g/mol) |
6,941 |
Densidad (g/ml) |
0,534 |
Punto de ebullición (ºC) |
1336 |
Punto de fusión (ºC) |
180,5 |
Calor específico (J/(K·kg)) |
3582 |
Conductividad eléctrica (S/m) |
10,8·106 |
Conductividad térmica (W/K·m) |
84,7 |
Dureza (escala de Mohs) |
0,6 |
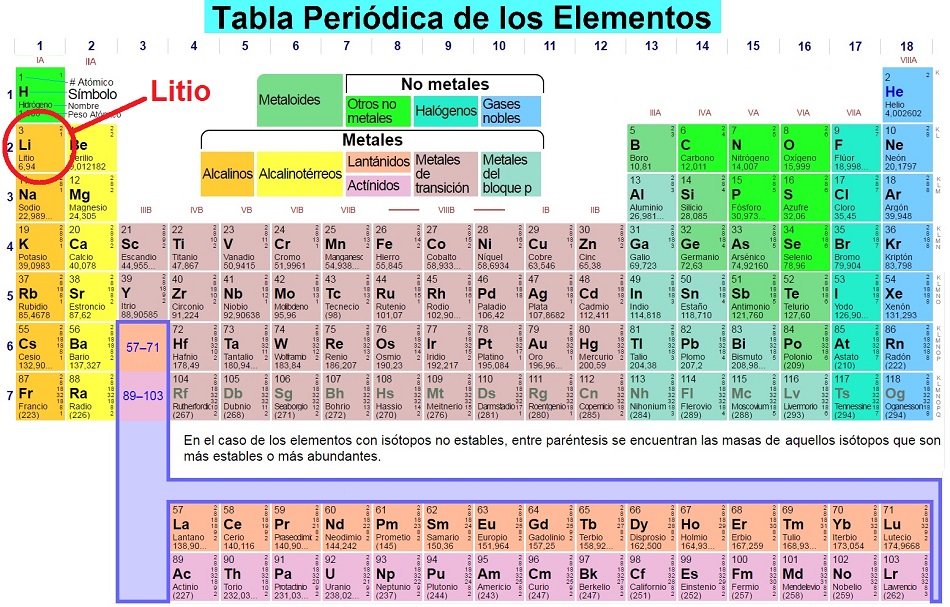
Haciendo clic en la siguiente figura, el lector podrá comprobar con mayor detalle el emplazamiento del Litio dentro de la Tabla Periódica de los Elementos:
— Tabla Periódica de los Elementos —
1.3- Presencia del litio en la naturaleza
El litio es un elemento moderadamente abundante en la naturaleza y está presente en la corteza terrestre en 65 partes por millón (ppm). El litio en estado natural se encuentra como una mezcla de los isótopos Li-6 y Li-7, siendo este último el isótopo de litio más abundante, dado que representa aproximadamente el 92,5% del litio presente en la naturaleza.
Se cree que el litio, junto con el hidrógeno y el helio, son los primeros elementos que aparecieron en el universo, estableciéndose su origen en el mismo Big Bang. Los demás elementos que conforman la tabla periódica fueron apareciendo posteriormente en sucesivas fusiones nucleares que tuvieron lugar en estrellas o por el estallido de supernovas.
El litio, dada su gran reactividad, nunca aparece solo en la naturaleza, sino que se encuentra asociado con otros elementos formando compuestos. En la antigüedad, el litio se solía extraer de ciertas rocas (de ahí el origen de su nombre, el vocablo griego lithos, que significa "piedra") donde aparecía en forma dispersa en su composición.
Básicamente, en la actualidad el litio se puede extraer a partir de tres tipos de depósitos principales: salmueras, roca dura volcánica y de ciertas rocas sedimentarias.
• Salmueras:
En la actualidad los depósitos de salmuera representan más de la mitad de los recursos de litio a nivel mundial. No obstante, el contenido en litio de cada salmuera es diferente, dependiendo de su origen y composición, por lo que el método de extracción empleado será adaptado según el tipo de salmuera y del lugar de donde se extraiga.
No obstante, en la actualidad la extracción de litio a partir de salmueras es la forma más rentable para su extracción, debido a su menor costo de producción en comparación con los métodos de extracción de litio a partir de roca dura.
Básicamente, se pueden distinguir tres tipos de salmueras: salmueras continentales, geotérmicas y asociadas a campos petrolíferos.
- Las salmueras continentales constituyen la forma más común de extracción de litio. De hecho, actualmente la mayoría de la producción de litio en el mundo proviene de este tipo de salmueras. Las salmueras continentales están presentes en salares y lagos salinos, como se puede encontrar en el Salar de Uyuni en Bolivia que constituye una de las principales reservas de litio del mundo, o el Salar de Atacama en Chile que también es una reserva importante de este mineral.
- Las salmueras geotérmicas se componen de una solución salina caliente, que circula a través de rocas de la corteza terrestre en zonas donde el flujo de calor es extremadamente alto y que hace que se enriquezca de elementos como el litio, boro y potasio. El Mar de Saltón, en el sur de California, es un ejemplo de este tipo de salmuera que contiene litio en su composición.
- Por último, están las salmueras de litio enriquecido que están presentes en algunos yacimientos petrolíferos, como ocurre en extracciones de petróleo de Wyoming, Oklahoma o el este de Texas en Estados Unidos.
• Depósitos de roca dura volcánica:
Otro de los depósitos desde donde se puede extraer el litio es a partir de rocas volcánicas, en concreto, de la pegmatita, formado a partir del magma cristalizado en el interior de la corteza terrestre.
Se trata de un mineral de roca dura que contiene litio, además de otros elementos como estaño, tantalio o niobio, y que se extrae a través de la explotación minera, tanto a cielo abierto como subterráneo.
El mineral extraído por esta técnica es procesado y concentrado usando una variedad de métodos químicos antes de su uso o posterior transformación en compuestos de litio.
No obstante, el procedimiento para extraer litio de la pegmatita o mineral de roca dura es caro, en comparación con los métodos de extracción de litio de depósitos de salmuera. Sin embargo, la concentración de litio presente en pegmatitas es considerablemente más alto que en las salmueras, por lo que en ciertas explotaciones mineras de roca dura su extracción puede ser rentable. Además, la extracción de otros elementos presentes en la roca dura además del litio, como el estaño o el tantalio hacen más rentable esta actividad de extracción.
Alaska, el norte de Ontario, Quebec, Irlanda y Finlandia son conocidas por sus yacimientos de litio en pegmatitas. Uno de los principales yacimientos con estas características se ubica en Greenbushes, Australia, el cual tiene un recurso estimado de 560,000 toneladas de mineral de litio, con una concentración media de alrededor del 1,6%.
• Depósitos de rocas sedimentarias:
Por último, también se puede encontrar trazas de litio en rocas sedimentarias, representando en torno al 8% de los recursos mundiales de litio conocidos, encontrándose presentes en diversas arcillas, e incluso, como curiosidad, se puede encontrar depósitos de litio en el agua de mar, en una concentración en torno a 0,17 p.p.m.
Pero además, la presencia de litio en las arcillas puede verse también debido a un proceso de enriquecimiento secundario, fundamentalmente por efecto del movimiento de aguas termales subterráneas entre las rocas.
1.4- Métodos industriales para la obtención de litio
Aunque el litio se puede encontrar tanto en depósitos de roca dura volcánica, en salmueras, en pozos petrolíferos, campos geotérmicos, arcillas e incluso en los océanos, en la actualidad sólo dos procesos extractivos son económicamente viables a nivel industrial, que son a partir de depósitos de roca dura y de salmueras.
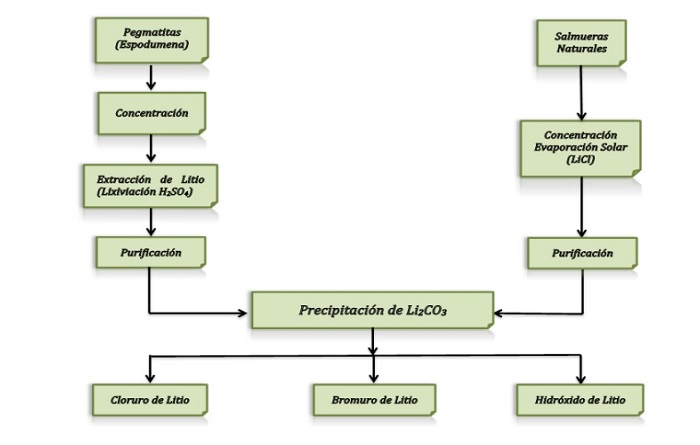
— Procesos productivos para la obtención de litio —
Tanto si los procesos industriales de obtención de litio sean a partir de salmueras o de roca dura, el resultado final es un precipitado de carbonato de litio (Li2CO3) que puede ser utilizado como materia prima para diversas aplicaciones industriales, o bien, para la producción a su vez de otros compuestos, como el hidróxido de litio (LiOH), cloruro de litio (LiCl) o el bromuro de litio (LiBr), empleados para otros tipos de aplicaciones.
• Obtención de litio a partir de depósitos de roca dura volcánica:
El mineral de roca dura que contiene litio en su composición se extrae a través de la explotación de minas, que pueden ser a cielo abierto o subterránea, usando las técnicas mineras tradicionales. Estos minerales pegmatíticos extraídos de la mina son posteriormente procesados en factorías donde se produce un concentrado de material, obtenido usando diversos métodos, con objeto de poder ser usado posteriormente para su transformación en otros compuestos de litio.
La espodumena, que es un mineral del grupo de los silicatos que proviene de la pegmatita, es aprovechada industrialmente como fuente de litio. Para ello, el mineral espodumena se concentra por flotación diferencial para obtener un concentrado con un contenido de entre un 2,5 al 3,2% de litio, lo que equivale a 85 a 95% de espodumena.
Para la producción de litio de la espodumena natural, el concentrado del mismo deberá ser calcinado previamente con caliza, para posteriormente y mediante procesos de molienda, lixiviación, precipitaciones sucesivas, entre otros, y dependiendo del agente tratante, se pueda extraer un alto porcentaje del litio, produciéndose en forma de hidróxido de litio (LiOH), carbonato de litio (Li2CO3) o cloruro de litio (LiCl).
• Obtención de litio a partir de salmueras:
El proceso para la obtención de litio a partir de salmueras ha tenido un gran desarrollo industrial últimamente debido fundamentalmente a que son procesos con un costo económico más bajo que los procesos para obtener litio a partir de los minerales pegmatíticos.
Debido a que dependiendo del tipo y procedencia de la salmuera que se vaya a procesar, los niveles de contenido en litio presente en su composición varía de una salmuera a otra. Además, en las salmueras suele haber presencia de otros elementos como potasio, sodio, calcio, magnesio, hierro, boro, bromo, cloro, nitratos, cloruros, sulfatos y carbonatos. Por todo ello, el proceso a seguir para la obtención de litio va a variar sensiblemente en función de la composición química de cada salmuera y su origen.
No obstante, se puede relacionar de una manera genérica las etapas más comúnmente seguidas en el proceso de tratamiento industrial de las salmueras para llevar a cabo la obtención de litio.
En primer lugar, la salmuera es bombeada hasta una serie de estanques de baja profundidad y de gran superficie a la intemperie, en los cuales, a partir de un proceso natural de evaporación del agua debido a la radiación solar, comienzan a precipitar de forma secuencial los distintos tipos de sales que contiene la salmuera. De este modo, se extraen sales tales como cloruro de potasio, cloruro de sodio, sulfato de potasio, sulfato de sodio, entre otras, así como sales de litio, las cuales presentan todavía presencia de trazas de magnesio, boro y sulfatos.
Posteriormente, esta salmuera concentrada de litio, resultado de la evaporación del contenido de agua, es recogida de las salinas de evaporación y transportada por camiones a las plantas de procesamiento, donde serán sometidas a diversos procesos de purificación y precipitación, con objeto de obtener como resultado carbonato de litio (Li2CO3), con una pureza cercana al 99,5%, que puede comercializarse en forma de cristales, o bien compactado en forma de gránulos para su comercialización.
Decir que el carbonato de litio es la materia prima que se utiliza industrialmente para la producción de hidróxido de litio (LiOH), o bien de cloruro de litio (LiCl) de alta pureza, que son los compuestos de los que se parte para la posterior obtención de manera industrial de litio metálico a partir de la electrólisis de estas sales fundidas.
Se muestran, a continuación, los procesos y reacciones químicas que se generan para la obtención de carbonato de litio, utilizando como ejemplo la salmuera del salar de Atacama en Chile.
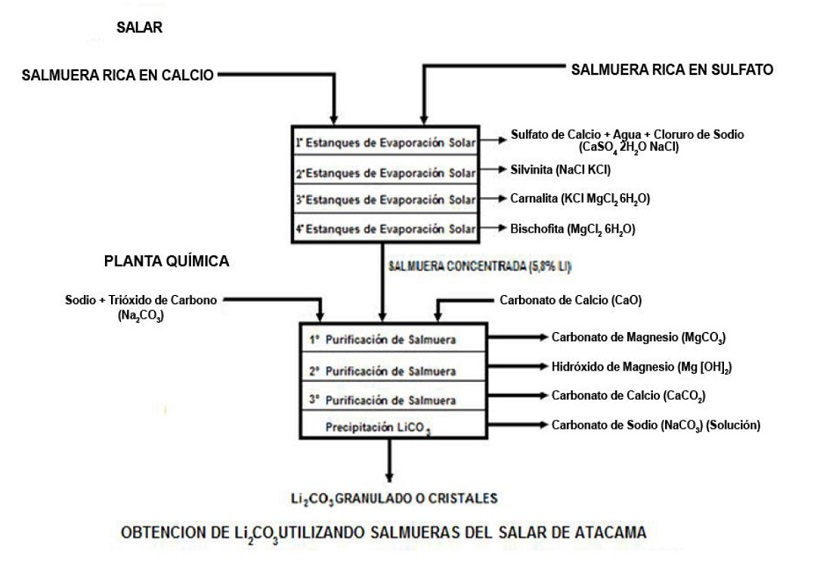
— Obtención de carbonato de litio a partir de salmueras del Salar de Atacama —
Asimismo, a continuación se muestran en los distintos diagramas de flujo relativos a los procesos de obtención del cloruro de litio y de litio metálico, a partir del carbonato de litio como materia prima:
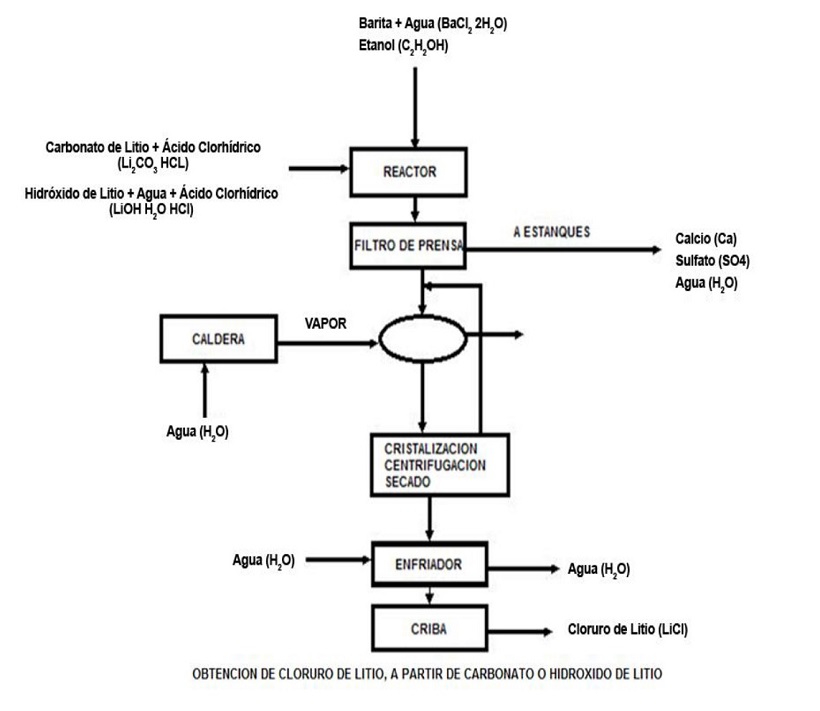
— Obtención de cloruro de litio a partir de carbonato de litio —
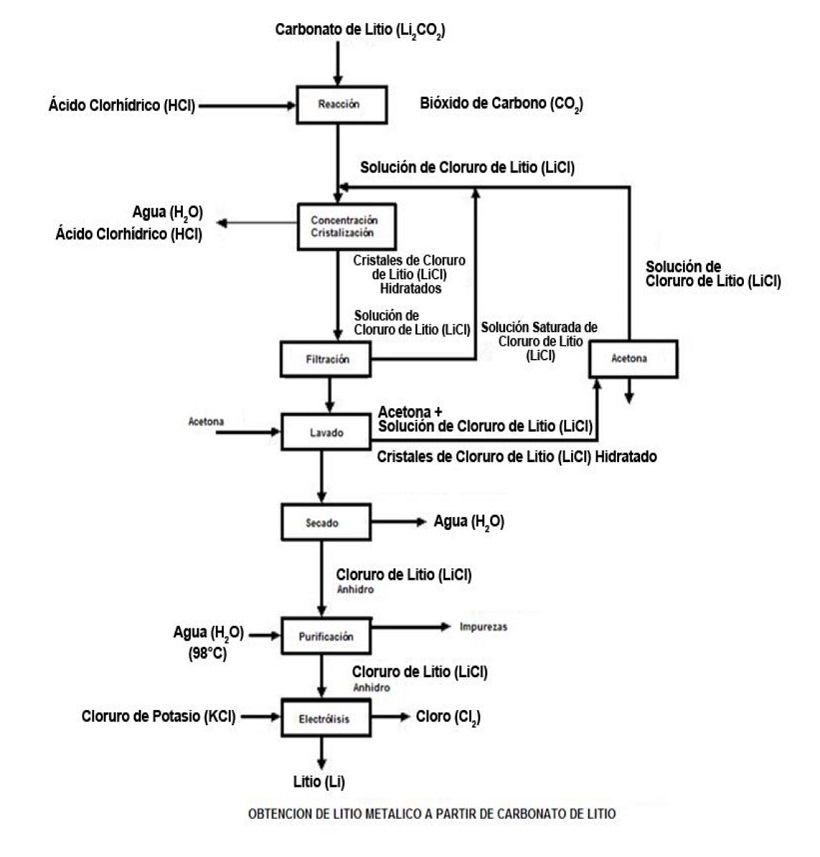
— Obtención de litio metálico a partir de carbonato de litio —
2- Principales aplicaciones del litio
2.1- Generalidades
El litio es un metal alcalino que tiene un calor específico realmente alto, en comparación con otros metales, característica ésta que va a ser empleada en muchas de sus aplicaciones que tengan relación con la transferencia de calor.
Además, al ser el litio un metal alcalino, univalente y muy reactivo, va a ser muy utilizado como un componente fundamental en aleaciones conductoras de calor y baterías eléctricas. También se le ha dado usos médicos para tratar trastornos de la mente debido a sus propiedades químicas, como se verá más adelante.
En todo caso, los métodos para la obtención de litio dan como resultado un precipitado de carbonato de litio (Li2CO3) que puede ser utilizado de esta manera como materia prima, o bien, para la producción de otros compuestos, como el hidróxido de litio (LiOH), cloruro de litio (LiCl) o el bromuro de litio (LiBr).
De todos los anteriores, el compuesto principal de litio que más se utiliza en distintas aplicaciones es el hidróxido de litio, que es un polvo blanco donde el material comercial es el hidróxido de litio monohidratado.
Por otro lado, el carbonato de litio también tiene mucha aplicación en la industria de la cerámica, de modo específico en la formulación de esmaltes para porcelana, y en la medicina como un antidepresivo. Tanto el bromuro como el cloruro de litio forman salmueras concentradas que tienen la propiedad de poder absorber mucha humedad en un intervalo amplio de temperaturas. Por eso, estas salmueras se van a emplear, por ejemplo, en los sistemas comerciales de aire acondicionado.
Pero también, el litio tiene uso industrial en forma de estearato de litio como espesante para grasas lubricantes. Otras aplicaciones importantes del litio es como aditivo para alargar la vida y el rendimiento en acumuladores alcalinos, y en la soldadura autógena y la soldadura para latón.
Por tanto, en la actualidad la utilización de los productos derivados del litio son diversos, de ahí la creciente importancia de este elemento en la economía mundial. Se adjunta a continuación una figura explicativa donde se agrupan de manera esquemática las principales aplicaciones de los compuestos de litio:
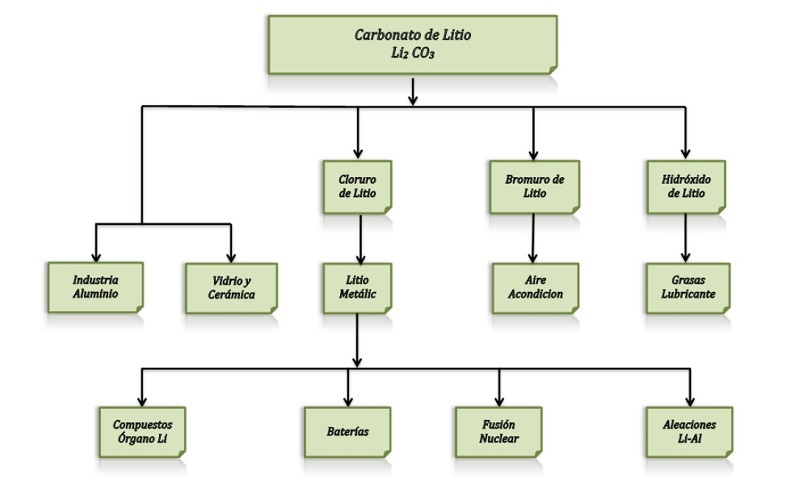
— Principales aplicaciones del litio —
A continuación, se estudia de manera un poco más detallada cada una de las principales aplicaciones que tiene el litio en la actualidad, así como cuáles pueden ser sus aplicaciones futuras.
2.2- Baterías de ion de litio
Gracias a su potencial electroquímico, el litio es un elemento que lo hace ideal para su utilización como ánodo (polo positivo) de las baterías eléctricas, tanto de aplicación en dispositivos electrónicos (ordenadores, móviles, etc.) como en vehículos eléctricos. Debido a estas excepcionales propiedades electroquímicas del litio, las baterías de ion litio, también denominadas denominada batería Li-Ion, son en la actualidad las más competitivas del mercado, dado que son capaces de almacenar más energía en menos espacio que las demás baterías que emplean otras tecnologías.
- Conceptos generales de una batería recargable:
Una batería recargable es un dispositivo capaz de almacenar energía eléctrica mediante reacciones electroquímicas de oxidación-reducción. Para que una batería funcione, primero deberá ser sometida a un proceso de carga de energía que será almacenada en la batería en forma de energía química.
Posteriormente, esta energía química almacenada en los electrodos de la batería es transformada en energía eléctrica mediante reacciones redox (reacciones reducción-oxidación) reversibles. Estas reacciones redox generan una transferencia de electrones entre los elementos activos de la batería, que son conducidos mediante un circuito exterior para suministrar electricidad para su uso.
• Celdas electroquímicas:
Toda batería recargable está formada por un conjunto de celdas electroquímicas, que se pueden considerar la unidad elemental y básica de la batería. Un conjunto de celdas conectadas entre sí conformarán una batería. La conexión entre celdas se podrá realizar en serie, en paralelo o una combinación de ambas, en función del voltaje y/o la intensidad de corriente que se quiera alcanzar con la batería.
Cada celda que constituye la batería estará formada por dos electrodos separados por un electrolito. Los electrodos suelen fabricarse de materiales compuestos o "composite" formados por un material que sea eletroquímicamente activo, un conductor electrónico que asegure la transferencia de electrones y un polímero que mejore las propiedades mecánicas del electrodo. En el electrodo negativo (ánodo) se dispondrá un material activo con menor potencial redox, mientras que el material activo empleado en el electrodo positivo (cátodo) tendrá un mayor potencial redox.
Adjunto, se incluye una tabla con los valores de los potenciales estándares de reducción para su consulta.
En lo referente al electrolito, en la mayoría de las baterías se utiliza un líquido con una elevada conductividad iónica que hace la función además de aislante electrónico. Para contener el líquido electrolito dentro de la celda, éste se embebe en un separador que evita también que los dos electrodos entren en contacto directo entre sí.
- Parámetros electroquímicos de una batería recargable:
Las prestaciones que pueda ofrecer una batería dependerá del tipo de celdas que la constituyan y su conexionado entre ellas. En general, los parámetros electroquímicos que se suelen utilizar para definir a una celda o a una batería son los siguientes:
• Fuerza electromotriz, voltaje o potencial: Este valor viene dado por la diferencia entre los valores de potenciales redox de los materiales que constituyen los electrodos positivo (cátodo) y negativo (ánodo). Conforme mayor potencial presente una celda mucho mejor, dado que permitirá utilizar menor número de celdas conectadas en serie para alcanzar el voltaje nominal de la batería. El voltaje o potencial de las celdas y las baterías se miden en voltios (V).
• Capacidad de carga: Este parámetro indica la cantidad total de carga eléctrica que almacena la batería. La unidad en que se mide este parámetro es el amperio·hora (Ah). Ejemplo, una batería de capacidad 100 A·h sería capaz de suministrar una corriente de 100 amperios durante una hora de servicio.
Cuando se comparan diferentes tipos de baterías entre sí, resulta útil calcular la capacidad de carga por kilo de batería (Ahkg-1) o por volumen de batería (Ahl-1). Evidentemente, conforme mayores valores alcancen estos parámetros, la batería resultará más eficiente, al ser capaz de almacenar más carga por unidad de masa de batería.
• Energía específica: Este valor indica la cantidad total de energía eléctrica que puede almacenar la batería. La unidad empleada para medir la energía acumulada por una batería es el watio·hora (Wh).
Igualmente, se suele utilizar la energía específica másica (Whkg-1) y la volumétrica (Whl-1), también denominada densidad de energía. Conforme mayores valores de energía específica másica o volumétrica, la batería será más eficiente y podrá almacenar más energía por unidad de masa de la batería.
• Ciclos de vida de una batería: Se refiere al número de ciclos de carga y descarga que puede soportar una batería hasta que su capacidad sea inferior al 80% de su valor nominal.
- Características de las baterías de ion-Litio:
Las baterías recargables de ion de litio o batería Li-Ion, deben su nombre precisamente porque utilizan compuestos de litio para la fabricación de uno de sus electrodos para cada celda de la batería.
Este tipo de batería ya se comercializaba desde la década de los 90, y se han ido añadiendo avances a su diseño desde entonces, sobre todo con el uso de nuevos cátodos de óxido de níquel, manganeso y cobalto, que han mejorado mucho la densidad de carga, el rendimiento y la seguridad de este tipo de baterías.
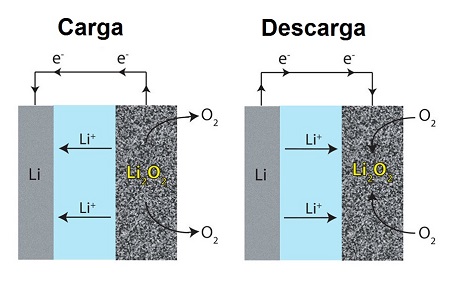
Como cualquier otra batería, las baterías de ion de litio se componen de un electrodo negativo o ánodo de donde salen los electrones y un electrodo positivo o cátodo que los recibe. Cuando se conecta la batería para su uso como fuente de electricidad, los iones de litio se mueven desde el ánodo hasta el cátodo a través de un electrolito, dando lugar a la diferencia de potencial que produce la corriente eléctrica. Cuando se carga la batería, los iones de litio van en sentido contrario y vuelven al ánodo.
Como ya se ha indicado, las baterías de ion de litio están constituidas por una o varias celdas y, dependiendo de su uso final, existirán diferentes tipos: las celdas cilíndricas, que son las que se usan en las baterías de la mayoría de vehículos eléctricos, y que consisten en láminas de distintos componentes que se enrollan hasta formar un cilindro; mientras que las celdas planas, como las que integran los teléfonos móviles y ordenadores portátiles, utilizan polímero de iones de litio en forma de láminas apiladas.
Además, las baterías de ion de litio incorporan otros elementos que mejoran su rendimiento y seguridad, como puedan ser un sensor de temperatura, un circuito regulador de tensión y un monitor de estado de carga. Estos componentes controlan la carga y el flujo de corriente, registran la última capacidad alcanzada en la carga completa y controlan la temperatura, parámetros éstos que puede afectar negativamente a la vida útil de la batería.
- Ventajas e inconvenientes de las baterías de ion-Litio:
Si se compara con otros tipos de baterías que emplean una tecnología tradicional como puedan ser las baterías recargables de hidruro de níquel o de níquel-cadmio, las baterías de ion de litio permiten una recarga de menos tiempo y ofrecen una mayor capacidad de carga, por lo que aguantan más tiempo en descargarse.
Pero además las baterías de ión-Litio presentan una mayor energía específica, no tienen efecto memoria, es decir, no reducen su capacidad de carga con cargas incompletas, y además pierden muy poca carga cuando permanecen un largo tiempo sin usarse.
Entre los inconvenientes de este tipo de baterías está en que, debido a su tecnología, es necesario dotar de sistemas de seguridad y protección al diseño de la batería con el fin de evitar que se produzcan sobrecargas y sobrecalentamientos que pueden resultar peligrosos. Por otro lado, los costes de producción de este tipo de baterías todavía siguen siendo superiores a otros tipos de baterías con tecnologías más tradicionales, debido principalmente al empleo de otros elementos necesarios para su fabricación que, como el cobalto, son escasos de obtener en la naturaleza.
- Aplicaciones de las baterías de ion-Litio:
Las ventajas que presentan las baterías de ion de litio, y porque cada vez se emplean nuevos métodos de fabricación que reducen su coste final, están haciendo que su uso esté cada vez más extendido en nuestra vida diaria. A continuación, se indican algunas de las aplicaciones más importantes de este tipo de baterías:
• En sistemas de energía de emergencia
Las baterías de ion de litio se emplean como fuente de apoyo en instalaciones críticas, como granjas de servidores, las baterías de un SAI (Sistema de Alimentación In-interrumpida), que permiten proteger a una instalación de cualquier fallo o pérdida en el suministro de electricidad.
• Almacenamiento de energía solar
Las baterías de ion de litio debido a su gran capacidad de almacenamiento y rapidez son muy empleadas para instalaciones de energía solar, sobre todo para aplicaciones de autoconsumo, con objeto de almacenar la energía y poder disponer de ella cuando no haya radiación solar, por ejemplo, de noche o en días nublados.
• Electrónica de consumo y dispositivos móviles
Posiblemente, los dispositivos móviles, ordenadores portátiles y demás dispositivos de electrónica se hayan convertido en la aplicación principal de las baterías de ion-Litio, debido principalmente, además de su gran capacidad de almacenamiento y que aguantan muchos ciclos de carga y descarga, porque permiten la fabricación de baterías cada vez más pequeñas y de reducido peso.
• En sistemas de asistencia y ayuda a la discapacidad
Las baterías de ion-Litio se usan mucho en sillas de ruedas eléctricas, salvaescaleras o prótesis motorizadas, facilitando la vida de las personas con restricciones de movilidad.
• Baterías de ion-Litio para vehículos eléctricos
También, una de las aplicaciones más demandada es como tecnología aplicada en la fabricación de baterías de almacenamiento para vehículos eléctricos e híbridos. Como ya se ha indicado, las baterías de ion-Litio presentan una gran densidad energética, lo que permite almacenar mayor cantidad de energía por unidad de masa de batería, soportan muchos ciclos de carga y descarga, y gracias a que cada vez los costes de fabricación de estas baterías se están reduciendo, están haciendo posible un mayor desarrollo del mercado de los vehículos eléctricos e híbridos.
2.3- Industria del aluminio y de aleaciones ligeras
Otra de las grandes aplicaciones del litio está en la industria del aluminio (Al), material muy utilizado en multitud de aplicaciones, como pueda ser en la industria de la aeronáutica, de la automoción, debido a que es un metal ligero y de gran resistencia a la corrosión.
El proceso metalúrgico para la obtención del metal de aluminio comienza a partir de la electrolisis de la alúmina (Al203) fundida en un baño de composición con un contenido en alúmina que varía del 2 al 8%, entre un 5 y 7% de fluoruro de aluminio, entre un 5 y 7% de fluoruro de calcio y entre un 80 a 85% de criolita (Na3·AIF6). Pues bien, a este baño fundido se le adiciona un 3,5% en peso de carbonato de litio (Li2CO3) en gránulos con respecto al peso del electrolito, lo cual permite obtener los siguientes beneficios en el proceso de fabricación del aluminio:
- Disminuye el punto de fusión del baño, así como la viscosidad
- Aumenta la conductividad eléctrica del electrolito fundido.
Gracias a estos cambios introducidos en el proceso, es posible trabajar con una temperatura de operación más baja, lo cual reduce el consumo de energía en el proceso de obtención del aluminio y también aumenta la eficiencia de la corriente eléctrica, lo que se traduce finalmente en un aumento de la productividad en el proceso de obtención del aluminio.
Además de las ventajas mencionadas, el litio permite reducir los consumos de ánodos de carbón y de criolita, y también reduce entre un 20% a 30% la emisión de flúor al ambiente, contribuyendo a reducir las emisiones contaminantes del proceso.
En la industria aeroespacial se está considerando el uso de aleaciones Al-Li para la fabricación de piezas tanto del ala como del fuselaje de los aviones. La utilización de esta nueva aleación aluminio-litio permitiría reducir significativamente el peso de los aviones en un 10%. Además de reducir sensiblemente el peso por su reducida densidad, también ofrecen una mayor resistencia a la corrosión, comparándola con las aleaciones tradicionales de aluminio.
Pero además, el litio tiene otros distintos usos en la industria metalúrgica en general. Así, el litio es muy empleado como elemento activo y eliminador de impurezas. Se recurre a este metal para refinar el níquel, cobre, zinc, hierro y sus aleaciones correspondientes. Consigue eliminar elementos no metálicos presentes en las coladas, tales como el nitrógeno, carbono, azufre, oxigeno, hidrógeno y halógenos.
2.4- Industria del vidrio y la cerámica
El óxido de litio (Li2O) es un aditivo importante que se emplea mucho en la industria del vidrio y la cerámica. Su efecto es disminuir el punto de fusión y mejorar las propiedades de escurrimiento del material fundido, además de reducir el coeficiente de expansión térmica y de viscosidad del producto terminado. La fuente para obtener el óxido de litio (Li2O) más utilizada es el carbonato de litio (Li2CO3) y también se puede obtener a partir de concentrados de minerales de litio.
Para la fabricación de piezas cerámicas resistentes al choque térmico, llamadas comúnmente "pirocerámicas" (vajillas de loza, vidrio tipo Corning), se utiliza en su composición preferentemente concentrados de minerales de litio con bajo contenido de hierro.
Otra aplicación importante la constituye la fabricación de tubos de televisión monocromáticos y en colores. Hasta hace relativamente poco, los minerales concentrados de litio eran los que con mayor frecuencia se usaban en la industria del vidrio y la cerámica. Hoy en día se utiliza en su lugar el carbonato de litio, que ha llevado a la estabilización de su precio, además de contribuir a eliminar la utilización de otros compuestos que son más tóxicos.
2.5- Grasas y lubricantes
Ciertas sales de litio y ácido esteárico, como el estearato de litio, se emplean en la fabricación de lubricantes resistentes al uso a elevadas temperaturas.
El estearato de litio es una sal del ácido esteárico con el catión litio que tiene la función de espesar aceites, con el fin de elaborar grasas que son capaces de trabajar a altas temperaturas, por lo que es muy usado como lubricante, hidrofugante, antiapelmazante y desmoldeante. El estearato de litio es por tanto, uno de los derivados más utilizados en la industria, por ser una excelente sustancia lubricante, sobre todo en aplicaciones de temperaturas elevadas.
Por tanto, las grasas fabricadas a base de sales de litio, denominadas comúnmente como grasas multiusos, conservan sus propiedades lubricantes en un amplio rango de temperatura (desde 0º hasta 200ºC), además poseen muy buena resistencia al agua y a la oxidación, por lo que gracias a estas cualidades son muy utilizadas en todo tipo de aplicaciones, como en sectores del transportes, tanto industriales, militares, vehículos, máquinas y también en aplicaciones marinas. Este tipo de grasas representan alrededor de un 60% de todos los lubricantes producidos en la mayoría de los países industrializados.
2.6- Sistemas de aire acondicionado y control de humedad
El bromuro de Litio (LiBr) y el Cloruro de Litio (LiCl) en forma de salmueras, se usan mucho en sistemas industriales de acondicionamiento y deshumidificación del aire, aprovechando que ambos compuestos tienen propiedades altamente higroscópicas, es decir, que le permiten absorber enormemente la humedad del aire, permitiendo así secar el aire en el interior de estancias y compartimientos cerrados.
2.7- Fabricación de caucho sintético
En la fabricación de elastómeros sintéticos se suelen utilizar compuestos órgano-Litio, como catalizadores de polimerización de plásticos, como el polietileno. El litio es utilizado en este tipo de aplicaciones en forma de butil-litio.
Este compuesto órgano-metálico es un catalizador específico en la polimerización iónica también del isopreno, estireno y butadieno, compuestos empleados para la obtención de cauchos especiales que tienen aplicaciones en la industria de fabricación de neumáticos de alta duración, y con gran resistencia a la abrasión. El N-butil-litio reacciona con el estireno y butadieno, formando una goma sintética que no requiere vulcanización.
2.8- Psicofármacos
Las sales de litio, específicamente el carbonato de litio (Li2CO3) y el citrato de litio, son empleadas en la medicina psiquiátrica como estabilizador de ánimo, ya que se usan para tratar manías, bipolaridad, depresión y distintas psicopatologías, al actuar inhibiendo los episodios de manía y de depresión asociados con trastornos de bipolaridad y otros trastornos anímicos.
En realidad, el litio funciona como un excelente estabilizador del ánimo. Cuenta con varios mecanismos de acción que permiten tratar a los pacientes de forma efectiva, de manera que los pacientes con ciertos trastornos psicológicos tratados con litio logran conseguir la calma.
Pero además de los psicofármacos, con el litio se ha potenciado su uso en el mercado farmacológico en general, debido a la incorporación del litio metálico y algunos compuestos que se utilizan como catalizadores en la producción de analgésicos, agentes anticolesterol, antihistamínico, anticonceptivos, inductores del sueño, algunos tipos de esteroides, tranquilizantes, vitamina A y otros productos, además del ya visto carbonato de litio que es utilizado en el tratamiento de la psicosis maníaca depresiva.
2.9- Depuradores de aire
El hidróxido de litio (LiOH) es un excelente compuesto que se usa para extraer del aire el dióxido de carbono (CO2) que se acumula, por ejemplo, por la actividad respiratoria de las personas. En este sentido, el hidróxido de litio se puede emplear como depuradores de aire para extraer el dióxido de carbono en submarinos y naves espaciales.
Por tanto, el hidróxido de litio es uno de los compuestos fundamentales que más se emplean en las industrias marítimas y espaciales, ya que es un producto que consigue depurar el aire, eliminando el dióxido de carbono presente en el ambiente.
2.10- Futuros usos para el litio
En base a las propiedades y característica del litio, se puede vislumbrar que existen tres mercados potencialmente importantes para este elemento en un futuro muy próximo, y que actualmente se encuentran ya en una etapa avanzada en cuanto a desarrollo tecnológico:
- Reactores de fusión nuclear
- Baterías secundarias (recargables)
- Aleaciones ligeras de aluminio-litio
• Reactores de fusión nuclear
Una aplicación potencial del litio que tiene grandes expectativas de desarrollo es en la producción de energía eléctrica mediante la fusión nuclear controlada a partir de los elementos deuterio y tritio. Esta fuente de energía sería hipotéticamente inagotable, pues el deuterio está presente en el agua de mar y el tritio también es muy abundante en la corteza terrestre.
No obstante, el tritio también se puede obtener alternativamente irradiando el litio con neutrones. El consumo de litio de esta forma como combustible para generar tritio no resultaría significativo, aunque sí podría serlo si además el litio fuera usado también como escudo contra radiaciones y como medio de transferencia de calor (litio-líquido).
• Baterías secundarias (recargables)
Debido a los altos precios de los combustibles fósiles y a la lucha por el cambio climático, la transición hacia un modelo de movilidad más sostenible con el medio ambiente parece imparable. En este sentido, el uso de vehículos eléctricos e híbridos es una alternativa que ya es real y que se va implantando en los distintos países del mundo.
Por ello, los distintos fabricantes de coches están dirigiendo ahora sus esfuerzos en el desarrollo de los vehículos eléctricos que emplean baterías recargables. En este sentido, se están realizando importantes esfuerzos en la investigación para desarrollar baterías recargables de litio de alta capacidad y mayor autonomía, a fin de ser empleadas en vehículo de propulsión eléctrica, pero también en otros tipos de aplicaciones, como en instalaciones de almacenamiento de energía para nivelación de carga.
• Aleaciones ligeras de aluminio-litio
Otro de los frentes abiertos en los avances tecnológicos es la búsqueda de nuevas aleaciones de materiales que sean más livianas y a la vez resistentes. En este sentido, aleaciones compuestas por un porcentaje de 1,5-3% de litio con aluminio permite obtener nuevos materiales que son de media un 10% más livianos que las aleaciones convencionales de aluminio.
Pero además de reducir el peso específico de estas nuevas aleaciones, el contenido de litio en la composición de las aleaciones de aluminio permite obtener nuevos tipos de aleaciones de mayor resistencia y mayor módulo de elasticidad que las utilizadas comúnmente, por ejemplo, en la fabricación de partes y componentes de aviones.
El uso de estas nuevas aleaciones de aluminio-litio en la industria aeronáutica, haría posible la fabricación de aeronaves más ligeras, lo que se traduciría en conseguir un ahorro significativo de combustible, el equivalente a un 20% de aumento de capacidad de carga del avión.
El principal inconveniente de estos nuevos materiales es su alto costo, que en parte se podría solucionar si se resuelven los problemas de reciclar los desechos generados en su fabricación. No obstante, los elevados precios de los combustibles derivados del petróleo pueden compensar en parte el uso de estas nuevas aleaciones.
3- Consideraciones sobre seguridad y salud en el uso del litio
3.1- Efectos del litio sobre la salud
A continuación, se enumeran qué efectos sobre la salud de las personas puede tener una exposición prolongada y en contacto directo con litio:
- Fuego y explosión: el litio es inflamable y puede ocasionar un riesgo serio de incendio. La mayoría de las reacciones químicas donde interviene el litio puede causar fuego o existir un riesgo importante de explosión. En este sentido, habrá que extremar la precaución por riesgo importante de incendio y explosión cuando el litio pueda entrar en contacto con sustancias combustibles o con el agua. Además, en caso de incendio donde esté presente el litio se pueden liberar vapores o gases irritantes y tóxicos para la salud.
- Inhalación: el litio cuando se calienta da lugar a la formación de vapores tóxicos. En caso de producirse una inhalación accidental de vapores de litio, esta situación podrá dar lugar a una sensación de quemadura en las vías respiratorias, incluso tos y respiración dificultosa. Suele ir acompañado también de un dolor agudo de garganta.
No obstante, a temperaturas próximas a los 20 ºC, la evaporación que se produce de trozos de mineral de litio es insignificante, sin embargo, cuando se dispersa en el ambiente puede alcanzar rápidamente una concentración peligrosa de partículas suspendidas en el aire. En todo caso, hay que tener siempre presente que entre otras vías de exposición al litio, esta sustancia puede ser absorbida por el cuerpo por inhalación de su aerosol.
La inhalación de vapores de litio puede causar edema pulmonar. Normalmente los síntomas del edema pulmonar no se manifiestan hasta después de unas horas y son agravados por el esfuerzo físico. El reposo y la observación médica son, por tanto, esenciales en caso de inhalación de los vapores de litio.
- Ingestión: en caso de ingerir partículas de litio, hay que tener presente que esta sustancia es corrosiva. Produce calambres abdominales, dolor abdominal y sensación de quemadura.
Su ingestión accidental genera náuseas, vómitos, sensación de debilidad, y en casos graves, puede desencadenar un estado de shock o colapso del organismo.
- Contacto con la piel y ojos: hay que tener presente que esta sustancia es corrosiva para los ojos, la piel y el tracto respiratorio. El contacto directo del litio con la piel genera un enrojecimiento de la misma. Si el contacto es prolongado puede producir quemaduras cutáneas, dolor y ampollas.
El contacto de esta sustancia con los ojos produce irritación ocular, enrojecimiento, dolor y si es prolongado podrá generar quemaduras severas y profundas.
3.2- Riesgos químicos del litio
A la hora de manejar el litio, conviene tener presente otros aspectos que son característicos de este elemento con objeto de mantener cierto grado de seguridad en el manejo de esta sustancia.
Se debe extremar la precaución ante cualquier aumento de temperatura que pueda afectar a los envases donde se almacene esta sustancia. Su calentamiento puede provocar una combustión violenta o explosión. De hecho, el litio puede arder espontáneamente en contacto con el aire cuando se dispersa en finas partículas.
Asimismo, el litio cuando se calienta da lugar a la formación de vapores tóxicos. Es una sustancia que reacciona violentamente con oxidantes fuertes, ácidos y otros muchos compuestos (hidrocarburos, halógenos, halones, cemento, arena y asbestos) lo que provoca que exista peligro de incendio y explosión.
También, el litio tiene una gran tendencia a reaccionar violentamente con el agua, formando gas hidrógeno altamente inflamable y vapores corrosivos de hidróxido de litio (LiOH).
3.3- Efectos medioambientales del litio
Como ya se ha indicado, el litio es una sustancia con gran tendencia a reaccionar con muchos elementos de la naturaleza, entre ellos los que están presentes en el aire de la atmósfera, como el nitrógeno, el oxígeno o el vapor de agua.
De hecho, el litio metálico reacciona muy fácilmente con el nitrógeno, el oxígeno, y el vapor de agua presentes en el aire. Como resultado, la superficie de este mineral se recubre de una capa formada por una mezcla de hidróxido de litio (LiOH), carbonato de litio (Li2CO3), y nitruro de litio (Li3N).
Como se sabe, el hidróxido de litio (LiOH) es una sustancia potencialmente muy peligrosa dado que es extremadamente corrosivo. Por ello, se deberá extremar la precaución de no hacer llegar minerales de litio en contacto con corrientes de agua, ríos o lagos, por el peligro que supone para la supervivencia de organismos acuáticos presentes en las masas de agua.
>> FIN DEL TUTORIAL
Volver a
Tutoriales
Información y consulta:
Hermenegildo Rodríguez Galbarro
info@ingemecanica.com - Tel. 646 166 055